Đề kiểm tra Học kì 1 Hóa học Lớp 8 - Năm học 2013-2014 - Trường THCS Vĩnh Trị (Có đáp án)
Câu 1
Cho khí metan CH4 nêu những gì em biết ? ( 1,5đ)
Câu 2
Tính hóa trị của mỗi nguyên tố trong hợp chất :
NaOH, biết (OH) hóa trị (I) ( 1,5đ)
Câu 3
Lập phương trình hóa học từ sơ đồ phản ứng sau : ( 3,0đ)
a.H2 + O2 ---> H2O
b.Na2CO3 + CaCl2 ----> CaCO3 + NaCl
c.Al + O2 ----> Al2O3
d.CaO + HNO3 ----> Ca(NO3)2 + H2O
Câu 4
Tính thành phần phần trăm của nguyên tố trong hợp chất
CuSO4 , biết (SO4) hóa trị (II)
Câu 5
Magie tác dụng với axit clohidric theo sơ đồ sau : Mg+HCl ----> MgCl2 +H2
Nếu có 2,4 g axit clohidric tham gia phản ứng, em hãy :
a. Lập phương trình hóa học của phản ứng?
b. Tính khối lượng magie cần dùng?
c. Tính thể tích khí hidro thu được ở đktc?
Bạn đang xem tài liệu "Đề kiểm tra Học kì 1 Hóa học Lớp 8 - Năm học 2013-2014 - Trường THCS Vĩnh Trị (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Đề kiểm tra Học kì 1 Hóa học Lớp 8 - Năm học 2013-2014 - Trường THCS Vĩnh Trị (Có đáp án)
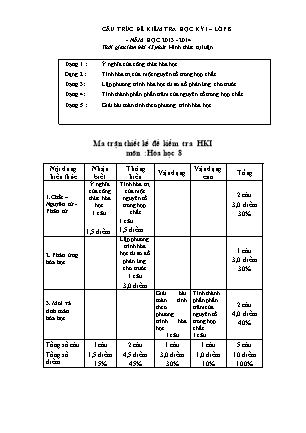
CẤU TRÚC ĐỀ KIỂM TRA HỌC KỲ I – LỚP 8 - NĂM HỌC 2013 - 2014 Thời gian làm bài 45 phút Hình thức tự luận Dạng 1 : Ý nghĩa của công thức hóa học. Dạng 2 : Tính hóa trị của một nguyên tố trong hợp chất Dạng 3: Lập phương trình hóa học từ sơ đồ phản ứng cho trước. Dạng 4: Tính thành phần phần trăm của nguyên tố trong hợp chất. Dạng 5 : Giải bài toán tính theo phương trình hóa học. Ma trận thiết kế đề kiểm tra HKI môn :Hóa học 8 Nội dung kiến thức Nhận biết Thông hiểu Vận dụng Vận dụng cao Tổng 1.Chất – Nguyên tử - Phân tử Ý nghĩa của công thức hóa học 1 câu 1,5 điểm Tính hóa trị của một nguyên tố trong hợp chất 1 câu 1,5 điểm 2 câu 3,0 điểm 30% 2. Phản ứng hóa học Lập phương trình hóa học từ sơ đồ phản ứng cho trước 1 câu 3,0 điểm 1 câu 3,0 điểm 30% 3. Mol và tính toán hóa học Giải bài toán tính theo phương trình hóa học 1 câu Tính thành phần phần trăm của nguyên tố trong hợp chất. 1 câu 2 câu 4,0 điểm 40% Tổng số câu Tổng số điểm 1câu 1,5 điểm 15% 2 câu 4,5 điểm 45% 1 câu 3,0 điểm 30% 1 câu 1,0 điểm 10% 5 câu 10 điểm 100% ĐỀ KIỂM TRA HỌC KỲ I – LỚP 8 NĂM HỌC 2013 - 2014 Thời gian làm bài 45 phút Hình thức tự luận Câu 1 Cho khí metan CH4 nêu những gì em biết ? ( 1,5đ) Câu 2 Tính hóa trị của mỗi nguyên tố trong hợp chất : NaOH, biết (OH) hóa trị (I) ( 1,5đ) Câu 3 Lập phương trình hóa học từ sơ đồ phản ứng sau : ( 3,0đ) a.H2 + O2 ---> H2O b.Na2CO3 + CaCl2 ----> CaCO3 + NaCl c.Al + O2 ----> Al2O3 d.CaO + HNO3 ----> Ca(NO3)2 + H2O Câu 4 Tính thành phần phần trăm của nguyên tố trong hợp chất CuSO4 , biết (SO4) hóa trị (II) Câu 5 Magie tác dụng với axit clohidric theo sơ đồ sau : Mg+HCl ----> MgCl2 +H2 Nếu có 2,4 g axit clohidric tham gia phản ứng, em hãy : Lập phương trình hóa học của phản ứng? Tính khối lượng magie cần dùng? Tính thể tích khí hidro thu được ở đktc? Cho C= 12 , H=1 , Mg=24 , Cl=35,5 , Cu= 64 , O=16 , S=32 ) Hướng dẫn chấm Thi học kì I Môn hóa 8 Câu 1 Khí metan CH4 do 2 nguyên tố : C và H tạo nên ( 0,5đ ) Có 1 nguyên tử C , 4 nguyên tử H trong một phân tử ( 0,5đ ) Phân tử khối CH4 = 12x1 + 1x4 = 16 (đvC ) ( 0,5đ ) Câu 2 a? I NaOH ( 0,5đ ) Ta có : ax1 = Ix1 ( 0,5đ ) => a = I ( 0,25đ ) Vậy Na ( I ) ( 0,25đ ) Câu 3 a.2H2 + O2 -> 2H2O ( 0,75đ ) b.Na2CO3 + CaCl2 -> CaCO3 + 2NaCl ( 0,75đ ) c.4Al + 3O2 -> 2Al2O3 ( 0,75đ ) d.CaO + 2HNO3 > Ca(NO3)2 + H2O ( 0,75đ ) Câu 4 M = 64 x 1 + 31 x 1 + 16 x 4 = 159 ( g/mol ) ( 0,25đ ) CuSO4 Trong 1 mol phân tử CuSO4 có : 1 mol Cu , 1 mol S , 4 mol O % mCu = ( 0,25đ ) %mS = ( 0,25đ ) %mO = 100% - (40,3% + 20,1%) = 39,6% ( 0,25đ ) Câu 5 Mg + 2HCl -> MgCl2 + H2 ( 0,5đ ) b. nHCl == = 0,1 ( mol ) ( 0,5đ ) nMg = x nHCl = x 0,1= 0,05 ( mol) ( 0,5đ ) mMg = nMg x MMg = 0,05 x 24 =1,2 (g ) ( 0,5đ ) x nHCl = x 0,1= 0,05 ( mol) ( 0,5đ ) x 22,4 = 0,05 x 22,4 = 1,12 ( l ) ( 0,5đ ) ( Có thể làm cách khác đúng vẫn tính điểm )
File đính kèm:
 de_kiem_tra_hoc_ki_1_hoa_hoc_lop_8_nam_hoc_2013_2014_truong.doc
de_kiem_tra_hoc_ki_1_hoa_hoc_lop_8_nam_hoc_2013_2014_truong.doc

